IL POTERE ASSORBENTE DEL SUOLO
Come assorbimento intendiamo la capacità del terreno di trattenere i nutrienti per renderli disponibili alle piante.
Possiamo distinguere quattro principali tipi di assorbimento:
· ASSORBIMENTO MECCANICO
· ASSORBIMENTO BIOLOGICO
· ASSORBIMENTO CHIMICO
· ASSORBIMENTO CHIMICO-FISICO O DI SCAMBIO
ASSORBIMENTO MECCANICO
Il terreno si comporta come un filtro nel quale le sostanze solide che non riescono ad attraversare i pori per percolamento vengono trattenute
ASSORBIMENTO BIOLOGICO
I vegetali e le piante assimilano azoto elementare, cationi e anioni che poi rilasciano nel terreno nella fase di mineralizzazione.
Questo assorbimento è particolarmente importante per gli ioni nitrato che solo per questa via sfuggono al dilavamento
ASSORBIMENTO CHIMICO
La condizione necessaria per questo tipo di assorbimento è lo sviluppo di reazioni che portano alla formazione di composti insolubili (precipitati) vediamone qualche esempio:
· Calcio + ione bicarbonato
Ca++ + 2 HCO3– -> Ca(HCO3)2 bicarbonato di calcio (solubile)
Ca(HCO3)2 -> CO2 + H2O + CaCO3 carbonato di calcio (insolubile)
· Calcio + ione solfato
Ca++ + SO4— -> CaSO4 solfato di calcio (insolubile)
· Calcio + acidi umici
Ca++ + acidi umici -> umato di calcio (insolubile)
· Calcio (anche ferro e alluminio) + perfosfato (solubile) in ambiente alcalino
3Ca++ + 2H2PO4– + OH– -> 4H2O + Ca3(PO4)2 (ortofosfato di calcio insolubile)
analoga reazione anche con Fe+++ e Al+++ (formazione di FePO4 e/o AlPO4)
· Idrolisi di sali di alluminio o ferro
Al+++ + 3H2O -> Al(OH)3 + 3H+ (idrossido di alluminio insolubile)
Fe+++ + 3H2O -> Fe(OH)3 + 3H+ (idrossido ferrico insolubile)
ASSORBIMENTO CHIMICO-FISICO O DI SCAMBIO
Si distingue in
1. Scambio cationico
2. Scambio anionico
Scambio cationico
Rappresenta il meccanismo più importante per il trattenimento dagli ioni.
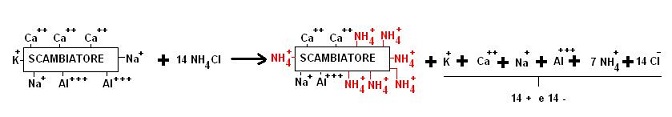
L’eccesso di carica negativa dei colloidi è neutralizzato da cationi, questi ultimi tuttavia possono essere sostituiti da altri cationi, tale sostituzione prende il nome di scambio cationico e la particella colloidale sede dello scambio prende il nome di scambiatore.
Il processo di scambio cationico può essere messo in evidenza mediante semplici esperienze.
Ad esempio trattando una colonna di terreno con del cloruro di ammonio (NH4Cl) a concentrazione nota, noteremo che nella soluzione uscente dalla colonna mentre le moli di ioni Cl– sono rimaste uguali le moli di NH4+ sono diminuite.
Poichè la soluzione di partenza era stechiometricamente neutra (non prevalevano cariche negative o positive) alcune moli di NH4+ saranno state sostituite da altre specie positive (ad esempio Ca++, Mg++, Na+, etc.) in modo che il bilancio di carica risulti uguale a zero.
Schematicamente:
L’entità della sostituzione dipenda da molti fattori che prenderemo in considerazione.
Bisogna tuttavia precisare che le condizioni di equilibrio o di sostituzione totale vengono praticamente raggiunte solo in laboratorio, nei terreni, infatti, l’azione di assorbimento dei cationi da parte delle piante e dei microrganismi e l’entità di concentrazione piuttosto basse non consente di raggiungere una condizione di reale equilibrio.
I fattori che giocano un importante ruolo nello scambio cationico sono:
· Concentrazioni relative di ioni
· Caratteristiche degli ioni (carica ed energia di idratazione)
· Caratteristiche dello scambiatore.
Concentrazioni relative di ioni:
Possiamo considerare lo scambio cationico come una reazione di equilibrio dinamico tale che per una specie chimica generica A che si scambia con una generica specie chimica B potremo scrivere la seguente espressione:
ne consegue che maggiori concentrazioni relative di B+ sposteranno l’equilibrio verso destra.
La reazione può essere spostata completamente verso destra nel caso il prodotto (nell’esempio A+) sia sottratto all’equilibrio.
Questa condizione si raggiunge se la specie chimica o è poco solubile, gassosa, oppure risulta poco dissociata, vediamo degli esempi pratici.
Argilla-H + NaOH -> Argilla-Na + H2O (poco dissociata)
Argilla-Al + NaOH -> Argilla-Na + Al(OH)3 (insolubile)
Argilla-H + CaCO3-> Argilla-Ca + H2O (poco dissociata) + CO2 (gas)
La concentrazione ionica non è però il solo fattore determinante.
I cationi sono infatti trattenuti in modo diverso dallo scambiatore, ne consegue che maggiore sarà l’interazione scambiatore ione, minore sarà la tendenza dello ione in questione a passare in soluzione.
Ad esempio due soluzioni identiche di NH4Cl sottraggono più ioni sodio che ioni potassio, questo a seguito del fatto che lo ione potassio viene trattenuto in maniera più energica dallo scambiatore.
Nasce quindi l’esigenza di fare una precisazione:
Definiamo contenuto totale in cationi tutti i cationi presenti nel terreno, di questi distinguiamo:
1. Cationi non scambiabili = cationi che fanno parte del reticolo cristallino e cationi presenti tra gli strati dei fillosilicati
2. Cationi provenienti da sali solubili
3. Cationi scambiabili, la cui somma espressa in milliequivalenti/100g di terreno, identifica la capacità di scambio cationico (CSC)
Caratteristiche degli ioni
Poichè il fenomeno di interazione tra ione e scambiatore è di tipo elettrostatico ne consegue che maggiore è la carica in gioco maggiore è l’entità della interazione.
Per questo motivo, a parità di concentrazione, gli ioni poliprotici (con più cariche positive) sono maggiormente fissati sullo scambiatore di quelli a carica ridotta.
Ad esempio tra Fe+++, Ca++ e K+ lo ione maggiormente fissato sullo scambiatore sarà il ferro, mentre quello meno
Un caso particolare è quello dello ione H+ che ha una tendenza simile a quella di cationi aventi carica maggiore.
Attenzione ricordarsi che più uno ione è fissato sullo scambiatore minore sarà la sua tendenza ad essere sostituito e maggiore sarà la usa tendenza a sostituire un altro ione.
Oltre al numero di cariche presenti sullo ione un altro aspetto da tenere presente è il raggio atomico.
Prendiamo ad esempio in considerazione alcuni elementi dello stesso gruppo della tavola periodica
Li+, Na+ e K+.
Di questi ioni la tendenza a fissarsi sullo scambiatore in maniera più stabile è quella del potassio (avente raggio atomico maggiore), mentre il litio presenta una minore tendenza ad essere fissato.
Questo comportamento è simile per tutti i gruppi, ne consegue che maggiore è il raggio atomico, maggiore è la tendenza a parità di altri fattori ad essere fissato sullo scambiatore.
Il motivo di questo fenomeno è legato alla energia di idratazione.
Ogni catione ha una tendenza a fissare in maniera abbastanza stabile delle molecole di acqua.
L’energia di idratazione è per l’appunto l’energia necessaria per staccare queste molecole di acqua dal catione.
Attorno agli ioni si forma un guscio di molecole di acqua che sarà tanto maggiore quanto è maggiore l’energia di idratazione.
Gli elementi aventi raggio atomico più piccolo hanno maggiore energia di idratazione e quindi gusci di dimensioni maggiori.
Questi gusci di acqua schermano le interazioni tra ione e scambiatore, ne consegue che ioni con energia di idratazione maggiore (e quindi con raggio atomico più elevato) saranno fissati in maniera più stabile allo scambiatore.
Volendo ordinare alcuni elementi secondo la tendenza ad essere fissati sullo scambiatore avremo per esempio:
Ba++, Sr++, Ca++, Mg++, Cs+, K+, NH4+, Na+, Li+
+fissato ————————————— -fissato
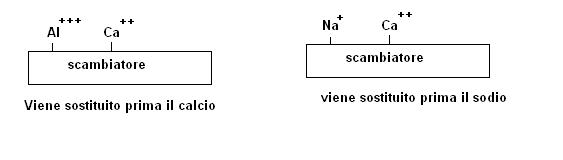
Qualora su uno scambiatore ci fossero più specie presenti, sempre a parità di altri fattori verrà sostituita per prima quella meno fissata, ad esempio
Va comunque ricordato che le considerazioni fin qui condotte riguardanti le caratteristiche degli ioni sono sempre legate al presupposto di concentrazioni equivalenti, l’aspetto legato alla concentrazione è infatti prevalente rispetto a quello legato alle tendenze di un singolo ione a restare fissato sullo scambiatore.
Caratteristiche dello scambiatore
Il supporto di scambio può essere costituito da:
1. argilla
2. sostanza organica
La capacità di scambio delle argille dipende da diversi fattori tra i quali ricordiamo per esempio le sostituzioni isomorfe.
Abbiamo visto che la sostituzione isomorfa del Silicio e dell’Alluminio provocano una eccedenza di cariche negative che vengono neutralizzate da altri ioni.
Potremmo pensare quindi che a maggiore sostituzione isomorfe sia associata una maggiore capacità di scambio ionico, questo corrisponde al vero solo in parte.
In una argilla a tre strati ad esempio solo le sostituzioni isomorfe degli strati esterni sono coinvolte in un aumento della capacità di scambio, gli ioni intrappolati nello strato centrale non sono disponibili allo scambio.
Per le argille a due strati notevole importanza ai fini della capacità di scambio cationica è rivestita dagli idrogeni dei gruppi OH uniti allo strato di Alluminio.
Per quanto riguarda la sostanza organica, la capacità di scambio cationico, che in genere è maggiore di quella delle argille, risulta comunque molto variabile ed associata a fattori quali:
Il grado di umificazione
al grado di ossidazione (più e ossidata maggiore è la capacità di scambio)
al pH (più è basico maggiore è la tendenza ad essere ossidata e quindi maggiore è la capacità di scambio).
Anche nella sostanza organica una notevole influenza sulla c.s.c è rivestita dai gruppi più o meno acidi presenti che sono in grado di scambiare ioni H+ con altri cationi.
La determinazione della capacità di scambio cationico
Abbiamo visto come sia le argille che il materiale organico abbiano parte della loro capacità di scambio cationico legata alla liberazione di ioni idrogeno (H+).
Possiamo immaginare il seguente equilibrio
Scambiatore-H <–> Scambiatore– + H+
Se la concentrazione degli H+ aumenta l’equilibrio si sposta verso sinistra per cui la c.s.c diminuisce.
In altre parole la c.s.c. è influenzata dal pH.
Bassi valori di pH, ossia molti ioni H+, riducono la c.s.c rendendo meno disponibili allo scambio gli ioni idrogeno fissati sullo scambiatore.
Per questo motivo la c.s.c viene misurata a pH 7 salvo altre specifiche, avremo infatti:
· c.s.c. TOTALE misurata a pH= 7
· c.s.c. MASSIMA misurata a pH> 8 (basico quindi meno H+ in soluzione)
· c.s.c. PERMANENTE misurata a pH= 2,5 (dovuta solo alle sostituzioni isomorfe essendo gli idrogeni molto fissati)
· c.s.c. VARIABILE TOTALE – PERMANENTE
· c.s.c. ARGILLA misurata a pH=7 dopo avere eliminato la frazione organica
· c.s.c. ORGANICA TOTALE – ARGILLA
I metodi ufficiali per la determinazione della c.s.c sono contenuti nella Gazzetta Ufficiale 21.10.99 e sono due uno cono ammonio acetato l’altro con Cloruro di bario e trietanolammina.
– Con Ammonio Acetato.
Si satura un terreno con ammonio acetato (NH4Cl) a pH7 in modo che lo ione ammonio sostituisca gli altri cationi.
Si esegue quindi la determinazione dello ione NH4 contenuto nel terreno.
-Con Cloruro di Bario e trietanolammina (quest’ultima stabilizza il pH a 8,2)
Si satura il terreno con i reagenti, quindi si aggiunge una soluzione a concentrazione nota di MgSO4.
Il Magnesio sostituisce il bario che precipita come BaSO4.
Si determina l’eccesso di magnesio che non ha sostituito il Bario e per differenza si ricava la c.s.c.
Per la determinazione pratica effettuata vedere la scheda di laboratorio
Capacità di scambio anionico
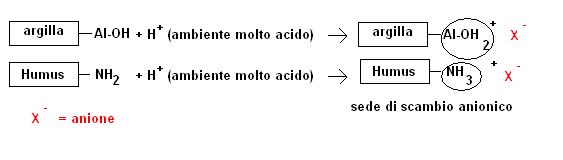
La capacità di scambio anionico a causa del carattere elettronegativo dei colloidi del suolo riveste poca importanza.
Tuttavia a pH molto bassi (terreni molto acidi) alcuni elementi anfoteri, ed in particolare l’alluminio e i gruppi amminici, si possono comportare da basi, fissare stabilmente uno ione H+, caricarsi positivamente ed agire da centri di scambio anionico.
In generale nei terreni a pH normali più che di scambio anionico bisogna parlare di assorbimento chimico conseguente alla formazione di composti insolubili o di adsorbimento specifico.
Il caso più importante è quello del fosforo.
Il fosforo può essere assorbito chimicamente se lo ione PO4— risulta in grado di strappare Alluminio o Ferro dall’argilla formando un precipitato di Al3PO4 o di FePO4 oppure adsorbito specificatamente se reagisce ancora con i due metalli lasciandoli però ancora uniti ai colloidi argillosi.
Il pH del terreno
Attraverso la determinazione della capacità di scambio totale determiniamo in pratica quello che viene considerato il complesso di scambio ossia l’insieme dai cationi:
Al+++ ,H+ ,Ca++ ,Mg++ ,K+ ,Na+ , e NH4+ scambiabili
Una sostanziale differenza esiste tuttavia tra gli ioni Al+++ e H+ da una parte e gli altri cationi, denominati nell’insieme basi di scambio, dall’altra.
Gli ioni Al+++ e H+ sono infatti i principali responsabili dell’acidità di un terreno.
Ricordiamo che il pH viene calcolato grazie alla seguente relazione:
pH = -log [H+]
Ne consegue che gli ioni H+ influenzano direttamente il pH del terreno, ma come possiamo spiegare l’acidità legata alla presenza dell’alluminio.
La risposta è legata al fenomeno di idrolisi degli alluminosilicati , ricordiamo che l’idrolisi è quel fenomeno per cui dalla dissoluzione in acqua di sali si ottiene una modifica del pH.
La reazione che possiamo immaginare è la seguente:
Argilla-Al+++ + H2O -> Argilla-Al(OH)++ + H+
Argilla-Al(OH)++ + H2O -> Argilla-Al(OH)2+ + H+
Argilla-Al(OH)2+ + H2O -> Argilla-Al(OH)3 + H+
Si assiste alla liberazione di ioni H+ e quindi ad un aumento dell’acidità
Un terreno ricco di ioni Al+++ e H+ scambiabili viene definito insaturo, se al contrario a predominare sono gli altri cationi (basi di scambio) il terreno viene definito saturo.
Un terreno saturo avrà perciò maggiori caratteristiche basiche, mentre un terreno insaturo maggiori caratteristiche acide.
Viene definito grado di saturazione basico di un terreno (G.S.B) è il rapporto tra il contenuto di basi di scambio rispetto alla capacità di scambio totale.
Come abbiamo visto il pH viene calcolato sulla base della concentrazione degli ioni H+ presenti in soluzione.
In un terreno troviamo sia una componente liquida (soluzione circolante) che una componente solida (organica e inorganica).
Sia nella componente liquida che nella componente solida del terreno possiamo trovare degli ioni H+ , mentre però gli ioni H+ presenti nella soluzione esplicano un effetto immediato sul pH, quelli adsorbiti sul suolo avranno un effetto sul pH solo nel momento in cui verranno rilasciati nella soluzione.
Possiamo quindi distinguere in un terreno due tipi di acidità:
1. acidità attuale legata alla concentrazione degli ioni H+ in soluzione (si esprime in un breve periodo)
2. acidità potenziale legata agli ioni H+ adsorbiti (si esprime in un lungo periodo).
Queste due forme in equilibrio tra di loro e la loro somma rappresenta l’acidità totale.
Per la determinazione sperimentale dell’acidità di un terreno guardare le schede di laboratorio.
Sulla base dei valori di pH i terreni vengono così classificati:
|
RANGE DI pH |
CLASSIFICAZIONE |
|
<4,5 |
estremamente acido |
|
4,6 – 5,5 |
molto acido |
|
5,6 – 6,0 |
acido |
|
6,1 – 6,7 |
subacido |
|
6,8 – 7,3 |
neutro |
|
7,4 – 8,0 |
subalcalino |
|
8,1 – 8,5 |
alcalino |
|
>8,5 |
fortemente alcalino |
Cause dell’acidità di un suolo e caratteristiche di un terreno acido
L’acidità di un terreno è in gran parte dovuta alla presenza di Al-argille e di H-argille, le prime in particolare sono quelle più importanti anche perchè si è dimostrato che con il tempo le H-argille si trasformano in Al-argille.
Le forti precipitazioni dilavano (liscivano) le basi di scambiabili ed i siti di scambio dei colloidi vengono occupati da idrogeno ed alluminio.
Circa il 90% dei fenomeni di acidificazione dei suoli è da attribuire a questa causa che come abbiamo visto è strettamente legata con la piovosità.
Tuttavia ci sono altri fattori che concorrono ad acidificare un terreno tra questi:
· solubilizzazione della CO2 , l’anidride carbonica prodotta dalle piante e dai microrganismi si può solubilizzare secondo la seguente reazione che porta alla formazione di acido carbonico.
H2O + CO2 -> H2CO3
L’acidità non è tanto dovuta alla produzione dell’acido carbonico (acido debole), ma soprattutto che dall’azione dello ione HCO3– (ione bicarbonato derivante dall’acido carbonico) che contribuisce alla solubilizzazione e quindi all’allontanamento degli ioni alcalini (in particolare dello ione Ca++)
· fenomeni ossidativi a carico di composti azotati o solforati; alcuni batteri possono ossidare i composti contenenti zolfo ad acido solforico ed i composti contenenti azoto ad acido nitroso o nitrico contribuendo alla acidificazione del terreno
· azione di scambio delle radici, le radici assorbono cationi e gli scambiano coni ioni H+, tanto che nei pressi dell’apparato radicale (rizosfera) il pH è di circa una unità più basso che nel resto della soluzione di scambio.
· uso di concimi acidi
Un terreno acido mostra in genere delle buone caratteristiche fisiche, l’acidità favorisce infatti fenomeni di aggregazione e di flocculazione che rendono il terreno permeabile e poco adesivo.
Accanto a questo lato positivo vi sono molti punti negativi che rendono tale terreno meno produttivo, tra questi citiamo:
· minore contenuto di basi di scambio e quindi di cationi nutritivi
· minore disponibilità di fosfati che reagiscono con l’alluminio presente formando composti insolubili non disponibili alle piante
· minore sviluppo microbico e quindi riduzione della umificazione
· maggiore solubilizzazione di microelementi che se in certi casi sono utili ad elevate concentrazioni possono avere azione fitotossica.
Cause dell’alcalinità dei terreni e caratteristiche di un terreno basico
I terreni alcalini possono essere costituzionali (fisiologici) o di assorbimento (patologici).
I terreni costituzionali sono legati alla presenza di notevoli quantità di carbonati e bicarbonati (principalmente di calcio e magnesio)
I carbonati/bicarbonati, come vedremo inseguito, costituiscono dei sistemi tampone, ossia dei sistemi a pH stabile che nel caso dei sali di calcio hanno valori intorno a 8,2 e nel caso del magnesio intorno a 9,0.
Proprio la costituzione di questi sistemi tampone impedisce ai terreni costituzionali di raggiungere valori molto alti di pH.
La situazione risulta molto diversa per i terreni di assorbimento che possono raggiungere valori di pH anche superiori a 10.
La maggior parte dei terreni di assorbimento derivano dall’evoluzione di terreni salini dove il contenuto di ioni di sodio risulta molto elevato.
Il catione maggiormente alcalinizzante è infatti il Na+, se esso costituisce almeno il 15% degli ioni scambiabili si ottengono fortissimi effetti di rialzo del pH.
Il Na+ è un catione proveniente da una base forte (NaOH) quindi tutti i sali che questo catione forma con degli acidi deboli danno una idrolisi molto basica.
Dalla liscivazione di terreni salini vengono liberate forti quantità di ioni Na+ che possono formare grosse quantità di Na2CO3 (carbonato di sodio) sale fortemente alcalino.
Per questo motivo terreni molto basici vengono a formarsi a seguito di fattori quali:
· zone aride; evapotraspirazione prevalente su percolazione e quindi concentrazione di specie saline
· depressioni con fondi impermeabili; si assiste alla concentrazione di specie saline
· presenza di falde salmastre
· vicinanze del mare; per trasferimento di acqua salmastra anche solo sottoforma di aerosol.
I suoli alcalini sono negativi allo sviluppo colturale per una serie di ragioni
1. dispersione dei colloidi e quindi distruzione della struttura del terreno con aumento della impermeabilità e la manifestazione di fenomeni di asfissia
2. formazioni di idrossidi insolubili di molti elementi che non sono più disponibili per le piante
3. riduzione della attività microbica e dei fenomeni correlati (vedi fissazione dell’azoto)
4. azione fitotossica di forti quantità di Na+
5. fenomeni osmotici negativi
Poiché come abbiamo già detto sono i terreni salini a provocare i maggiori effetti di alcalinizzazione, su questo tipo di terreni di operano dei trattamenti di bonifica.
La bonifica consiste nel migliorare la permeabilità dei terreni attraverso interventi agronomici e idraulici (ad esempio abbassamento falda salmastra e liscivare il terreno con irrigazioni).
Il potere tamponante del terreno
Nel terreno sono presenti diversi sistemi tampone che risultano attivi a diverse condizioni di pH.
Si ha un sistema tampone quando troviamo contemporaneamente presenti nel sistema una specie acida ed una specie basica debole correlate.
Se si cerca di abbassare il pH del sistema aggiungendo un acido forte, entra in gioco la specie basica debole che neutralizza parzialmente l’acido forte trasformandolo in un acido debole, nel caso in cui si aggiunga una base forte, sarà invece l’acido debole ad entrare in gioco trasformandosi nella base debole.
In entrambe i casi gli effetti delle aggiunte di specie acide o basiche saranno attenuate (tamponate), ed il pH del sistema risulterà stabilizzato.
Ogni sistema tampone ha un suo pH ottimale di funzionamento nei terreni in particolare avremo:
1) in ambiente acido
l’effetto tampone è determinato principalmente dall’Alluminio (in ambiente alcalino precipita come idrossido) e dai gruppi carbossilici e fenolici presenti nell’Humus (si comportano come acidi deboli).
Vediamo un esempio della capacità di una alluminio argilla di tamponare l’aggiunta di una base o di un acido
Argilla-Al(OH)++ + OH– -> Argilla-Al(OH)2+ [aggiunta di una base]
Argilla-Al(OH)++ + H+ -> Argilla-Al+++ + H2O [aggiunta di un acido]
2) in ambiente alcalino
l’effetto tamponante è regolato dalle reazioni di equilibrio del sistema carbonato bicarbonato
Correzione dei suoli acidi
Si esegue aggiungendo carbonati di calcio e magnesio che come abbiamo creano dei tamponi alcalinizzanti.
Analiticamente la quantità di calcare necessaria per innalzare il pH del suolo si esprime come fabbisogno in calce misurato in tonnellate di CaCO3 per 2000m3 di suolo.
Il metodo ufficiale per questa determinazione prevede il trattamento di 10g. di terreno con una soluzione tampone a pH 7,5 ed una successiva misurazione di questo parametro.
Il nuovo pH sarà minore di 7,5 e con l’ausilio di tabelle si valuta il fabbisogno in calce per portare il pH del terreno a valori stabiliti.
Correzione dei suoli alcalini
Si esegue in genere con il gesso (CaSO4), questo sale si comporta come un elettrolita acido dando le seguenti reazioni di neutralizzazione:
Na2CO3 (alcalino) + CaSO4 –> CaCO3 (Sol) + Na2SO4 (neutro)
Argilla-2Na + CaSO4 –> Argilla-Ca + Na2SO4 (neutro)
Per operare una acidificazione si può anche aggiungere dello zolfo che si ossida ad acido solforico per azione di microrganismi, in questo caso però i risultati sono molto più lenti.